La tuberculosis es una de las enfermedades con mayor morbilidad en el mundo. Según la OMS, aproximadamente una cuarta parte de la población mundial está infectada y por tanto expuesta a la enfermedad.
Se estima que 10 millones de personas enfermaron de tuberculosis en 2018. La morbilidad varía enormemente de un país a otro, desde menos de 5 a más de 500 nuevos casos por 100 000 habitantes y año, con una media mundial que se sitúa en torno a los 130 casos. En 2018 se registraron 1,2 millones de muertes por tuberculosis. España tiene una baja incidencia, con 4400 casos notificados en 2019 que dan una tasa de 9,34 casos/100.000 habitantes.
La infección Tuberculosa latente se define como un estadio de la infección tuberculosa en la que existe una carga de Mycobacterium tuberculosis complex viable en el organismo, pero que parece controlada por el sistema inmune y por tanto no se traduce en síntomas de enfermedad. La detección y tratamiento de la infección tuberculosa latente se ha convertido en una medida esencial de control de la tuberculosis en países de baja incidencia.
DIAGNOSTICO DE LA INFECCION TUBERCULOSA LATENTE
El diagnostico se realiza o por la reactividad de la prueba de la tuberculina (PT) o por algún método de liberación de interferón gamma, interferon gamma release assay (IGRA).
Prueba de la Tuberculina
El método diagnóstico clásico ha sido la prueba de la tuberculina (PT) o intradermorreacción de Mantoux. Es una técnica in vivo basada en la reacción de hipersensibilidad tipo IV que se produce en individuos sensibilizados frente a Mycobacterium tuberculosis complex tras la inyección intradérmica de un derivado proteico purificado (llamado PPD o tuberculina), que contiene una mezcla de más de 200 antígenos presentes en M. tuberculosis, en la cepa vacunal bacilo de Calmette-Guérin (BCG) y en micobacterias ambientales. El individuo infectado por M. tuberculosis reacciona a la PT con una respuesta de hipersensibilidad retardada mediada por células T, y a las 48-72 h aparece una induración en la zona de la inyección. Se realiza la lectura midiendo el diámetro transversal de la induración a las 72 horas.
Esta técnica representa una herramienta útil pero con limitaciones. La principal deficiencia radica en su reactividad cruzada que se traduce sobre todo en una baja especificidad en individuos vacunados con BCG y en infectados por micobacterias ambientales. En estos, es virtualmente imposible distinguir una respuesta positiva por una reacción verdadera de una reacción por otra causa. Además, la PT presenta una menor sensibilidad en individuos immunodeprimidos y niños pequeños con inmunidad no completamente madura Esta técnica presenta otros inconvenientes como la necesidad de dos visitas médicas, la subjetividad de la medición, o el efecto booster, fundamentalmente en personas mayores infectadas años antes o en personas vacunadas en la infancia, en donde una primera PT puede ser negativa y al repetirla 7-10 días después hacerse positiva debido a un efecto recuerdo en el sistema inmunitario.
Técnicas in vitro basadas en la liberación de interferón-gamma, IGRAs
Estas técnicas consisten en la estimulación in vitro de las células T circulantes en la sangre, mediante antígenos específicos del complejo M.tuberculosis. En el caso de que el individuo esté infectado, sus células T responderán liberando una amplia variedad de citoquinas que pueden ser detectables mediante técnicas inmunológicas. La citoquina detectada en las técnicas disponibles comercialmente es el interferón-gamma. La principal virtud de los IGRAs radica en los antígenos que utiliza para la estimulación de las células T: la proteína 6-kD M. tuberculosis early-secreted antigenic target (ESAT-6) y la 10-kD culture filtrate protein (CFP-10), codificados en la región de diferencia 1 (RD1). Estos antígenos específicos de M. tuberculosis no están presentes ni en el bacilo vacunal BCG ni en la mayoría de micobacterias ambientales. Los IGRA también presentan otra potencial ventaja, como es incluir controles negativos y positivos para identificar posibles reacciones inespecíficas y falsos resultados negativos. Los IGRA también se pueden ver afectados por la inmunosupresión, y su dificultad para responder a los antígenos de M. tuberculosis, si bien los estudios realizados parecen indicar que el impacto sería menor que sobre la prueba de la tuberculina.
La capacidad de la PT y de los IGRA de predecir el desarrollo de la tuberculosis es muy pobre, ya que un gran número de individuos con resultado positivo de la PT o los IGRA no progresarán hacia enfermedad tuberculosa. Aun con esta limitación, los IGRA han mejorado significativamente el diagnóstico de la infección tuberculosa latente. A pesar de presentar valores predictivos similares a la PT su mayor especificidad ha permitido reducir el número de tratamientos preventivos innecesarios.
Las 2 técnicas disponibles comercialmente son el T-SPOT®-TB y el QuantiFERON®-TB Gold Plus (QFT-Plus). La principal diferencia entre las técnicas reside en que mientras el QFT-Plus estimula sangre total y cuantifica la cantidad de IFN-gamma liberado mediante ELISA, el T-SPOT.TB cuantifica el número de células T que producen interferón en respuesta a la estimulación mediante ELISPOT.
QuantiFERON®-TB Gold Plus (QFT-Plus)
El ensayo QFT-Plus mide la reacción inmunitaria celular (RIC) ante antígenos peptídicos que simulan ser proteínas micobacteriana, ESAT-6 y CFP-1 O, las cuales no aparecen en ninguna cepa la BCG ni en la mayoría de las micobacterias no tuberculosas. Las personas infectadas por Mycobacterium tuberculosis complex suelen tener en la sangre linfocitos capaces de reconocer a estos antígenos micobacterianos. Este proceso de reconocimiento implica la generación y secreción de la citoquina, IFN-y. La detección y posterior cuantificación de este IFN-y constituye la base del ensayo.
El ensayo se lleva a cabo en dos fases. En primer lugar se recoge sangre total en cada uno de los cuatro tubos de recogida de sangre suministrados. El tubo 1 es el tubo de medición de nulos, serviría como blanco para ajustar los ensayos y como control negativo. Los tubos 2 (antigeno TB1) y 3 (antígeno TB2). contienen antígenos peptídicos asociados Micobacterium tuberculosis complex, ESAT-6 y CFP-1 O, diseñados para generar respuestas RIC a partir de linfocitos T cooperadores CD4+ , el tubo TB2 contiene además un conjunto adicional de péptidos cuya función es inducir respuestas RIC a partir de linfocitos T citotóxicos CD8. El tubo 4 es el tubo de mitógeno que se puede utilizar como control positivo y también como control para asegurar una correcta manipulación e incubación de la sangre. Los tubos para QFT-Plus deben incubarse a 37 ºC lo antes posible durante las 16 a 24 horas. Tras el periodo de incubación se centrifugan, se retira el plasma y se mide la cantidad producida de interferón IFN-y (Ul/ml) mediante el método ELISA. Se considera que el resultado del ensayo QFT-Plus es positivo si la producción de IFN-y en cualquiera de los tubos de antígeno TB es claramente superior al valor en Ul/ml de del tubo de nulos.
Aproximaciones futuras al diagnóstico de la infección tuberculosa latente
Actualmente se está trabajando en el desarrollo de nuevas aproximaciones que permitan mejorar globalmente el diagnóstico de la infección tuberculosa latente:
- Nuevas técnicas que mantienen el formato IGRA, pero que buscan la detección de otras citoquinas, como puede ser la IP-10; otros antígenos para estimular las células T, como dosR-regulon encoded proteins y los IVE-TB antigens, que se expresan cuando la bacteria está en condiciones de latencia. También se ha ideado un test similar a la PT inoculando de forma intradérmica los antígenos específicos ESAT-6 y CFP-10. Esta técnica in vivo podría ser una alternativa real a la PT convencional.
- Técnicas diagnósticas basadas en la detección de anticuerpos. Estos métodos, hasta el momento, se han mostrado poco útiles para el diagnóstico de la tuberculosis
- Marcadores celulares mediante citometría. Se ha observado que la disminución de la expresión del marcador celular CD27 en las células T-CD4 específicas de M. tuberculosis podría representar un marcador de tuberculosis activa.
Recomendaciones para la utilización de la prueba de la Tuberculina (PT) o los ensayos de liberación de interferon-gamma (IGRAs)
Las recomendaciones se realizaron en función de distintos grupos poblaciones y su riesgo de progresar a enfermedad activa en caso de estar infectados

Referencias
Informe Mundial sobre tuberculosis 2019 , OMS https://www.who.int/tb/publications/global_report/gtbr2019_ExecutiveSummary_sp.pdf?ua=1
Indicadores 2019 Tuberculosis, Ministerio de Sanidad https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/PlanTuberculosis/IND_SEG_PLAN_TB_2019_provisionales_web.pdf
Prospecto de Quantif ERON®-TB Gold Plus (QFT®-Plus) 2015, www.QuantiFERON.com
Miguel Arias Guillen. Avances en el diagnostico de la enfermedad tuberculosa. Arch Bronconeumol. 2011;47(10):521-530
José Dominguez, Irene Latorre y Miguel Santin. Diagnostico y abordaje terapéutico de la infección tuberculosa latente. Enferm Infecc Microbiol Clin. 2018;36(5)302-311
Dr. M. Óscar Llorente Campos. Analiza • Laboratorio Clínica Vistahermosa, Alicante

 English
English Português
Português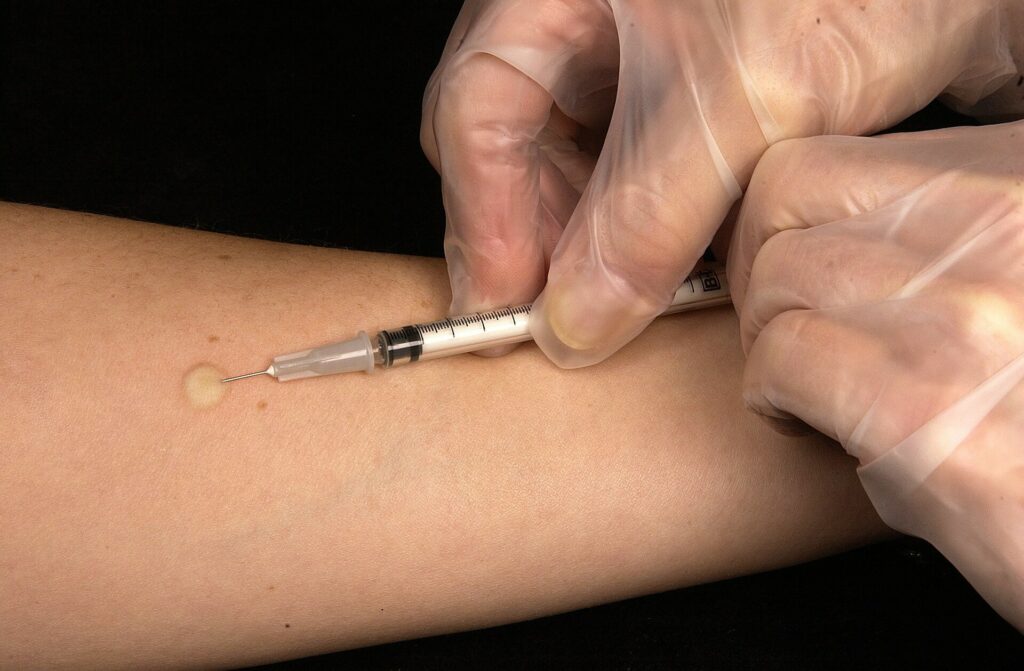
¿Quieres recibir noticias como ésta en tu email?
Suscríbete a la newsletter